康方生物用实力诠释了“强者没有寒冬”。
10月11日,康方生物以61.28港元每股(较上一交易日折让约4.99%)的价格配售3170万股,募资净额为19.2亿港元,这是康方生物年内第二次进行股票配售。据业内人士指出,本次认购的投资者以长线基金为主。

康方生物在本次股票配售完成后,公司预计现金、其他短期金融资产定期存款总额超过82亿港元。
在公司原有现金储备丰厚的背景下,相信公司未雨绸缪的募资很可能是基于公司年内推进了多项全球多中心临床,由于AK112海外临床由合作伙伴Summit负责,相信其中最重要的主角是CD47抗体AK117(连开两项MRCT)。

“天坑靶点”CD47,显然市场拥有很大分歧,为何康方生物选择死磕?值得细品。
01
CD47一路受挫,AK117前路光明
说CD47是“天坑靶点”不是没有道理的。
2023年可以说是CD47管线集中“爆雷”的大年,吉利德花费49亿美元收购的核心管线Magrolimab联合阿扎胞苷一线治疗高危MDS三期临床ENHANCE失败(随后2024Q1完全将Magrolimab的余下临床全部移除出研发管线),艾伯维在同年决定终止与天境生物Lemzoparlimab的合作(合作潜在总价20亿美元);除了MNC押注的分子纷纷折戟外,最早布局CD47靶点的先驱Arch Oncology也宣布终止其在CD47抗体上的研发工作,而另一家核心管线为CD47药物的ALX Oncology也宣布终止核心管线SIRPα融合蛋白Evorpacept治疗MDS、AML的临床,转向ADC的研究开发。
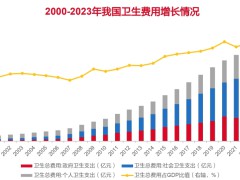
可从全球CD47单抗与融合蛋白研发情况看到,2019年以前进入临床的管线几乎“全军覆没”。
巨噬细胞是一种广泛分布于全身血液、组织的免疫细胞,能够吞噬和杀灭胞内寄生虫、细菌、肿瘤细胞、以及自身衰老和异常的细胞,属于人体的先天性免疫。而CD47是调节巨噬细胞吞噬功能的最有前景的靶点之一,由于CD47在于肿瘤细胞上高表达,能够向巨噬细胞传递“别吃我”信号(与巨噬细胞表面的SIRPα结合),并战胜肿瘤细胞上表达的“吃我”信号(如钙网织蛋白等),从而屏蔽巨噬细胞的吞噬功能。CD47相关管线,通过阻断CD47/SIRPα信号通路,就可以恢复巨噬细胞对肿瘤细胞的吞噬。
那么,过往遇挫的管线问题出在哪里?
成药难点基于两个大的层面:1)血液毒性:CD47还维持着人体内的红细胞平衡,部分初代CD47抗体与正常的红细胞结合导致血凝反应、血小板减少等副作用,造成严重血液毒性;2)疗效不足:这个层面牵扯到CD47药物在有效性和安全性上的平衡,一方面抗原沉默可能削弱部分CD47药物有效性,另一方面部分开发者为了降低血液毒性副作用在改良药物时选择了IgG4亚型的Fc端,阉割了抗体的杀伤力,使得药物效力进一步下降。

针对这些问题和经历了先驱们的早一代改良方法的失败(包括:改造抗体Fc端、预激给药等),新一代药物的开发者普遍的改造方式集中在这几个方面:1)海选只识别癌细胞CD47的抗体(或红细胞反筛选);2)将CD47做成双抗或者主开联合疗法临床,发挥“1+1>2”的作用;3)将目光放在SIRPα上(特殊的SIRPα结合CD47的结构域策略)。
康方生物的AK117,在成药性上无疑是颇具希望的。
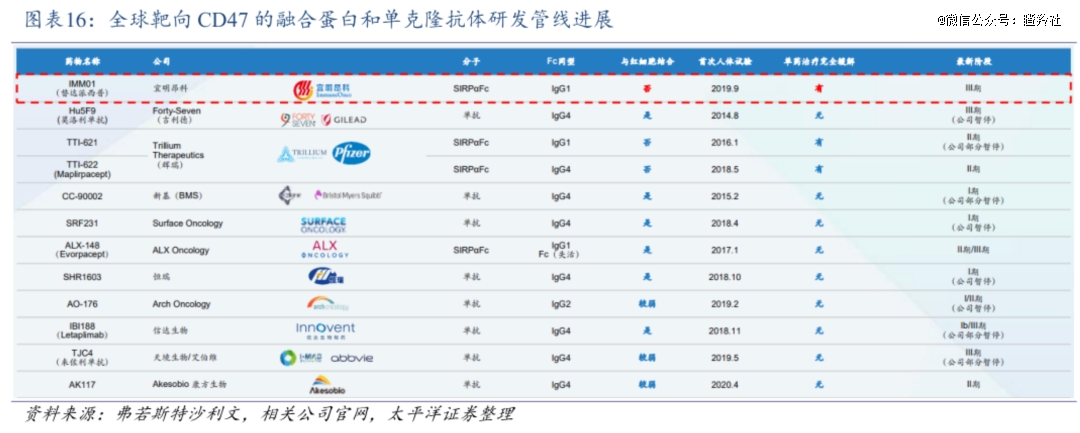
康方生物的的AK117,是一款不诱导红细胞凝集的CD47阻断抗体,在红细胞凝集试验中其在高达3000nM的浓度下也不诱导红细胞凝集(Hu5F9-G4在低至4.1nM的浓度下可诱导),这背后机制AK117与两个CD47蛋白结合构像相关。
另外,在已经完成的I期爬坡试验中,AK117最高给药队列为45mg/kg QW,各个剂量爬坡队列受试者中均未发生剂量限制性毒性(DLT)和未出现有临床意义的贫血。
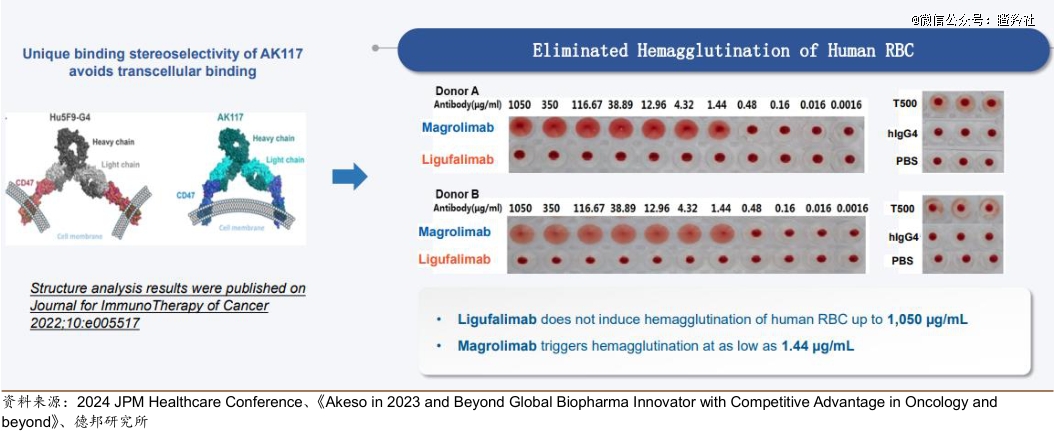
疗效层面,康方生物在ASH 2023大会公布的高危骨髓增生异常综合征 (HR-MDS)的Ib期临床数据显示:在27例可评估的患者中,完全缓解(CR)率为48.1%,总缓解率(ORR)为 85.2%。尽管样本量不大,这样的初步数据丝毫不弱于过往吉利德、艾伯维同类管线的疗效表现。
02
布满荆棘路途终点的奶与蜜
AK117,为何值得康方生物这样“大动干戈”?是时候谈论市场空间问题。
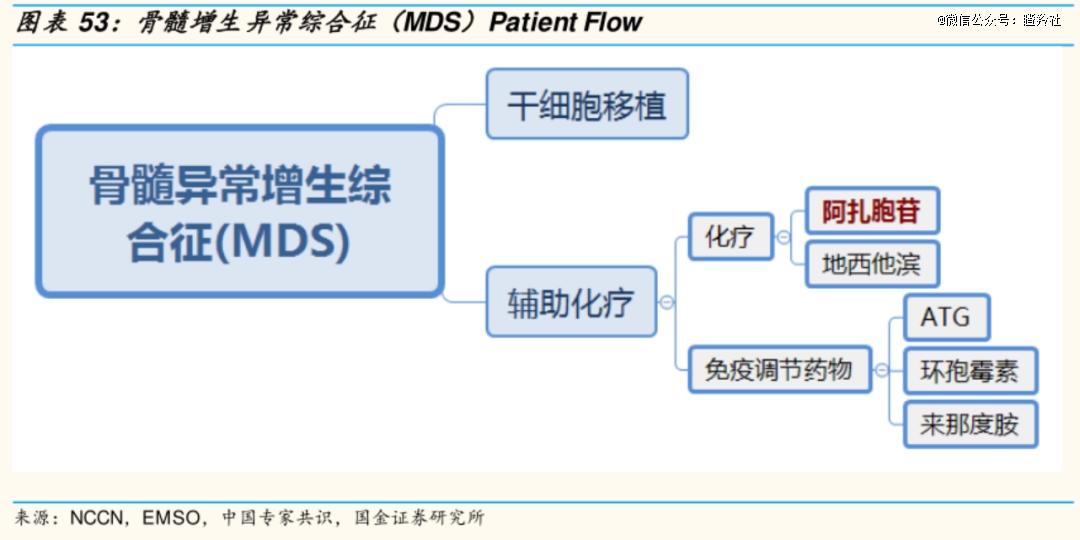
CD47靶点的核心适应症市场必然离不开骨髓增生异常综合征(MDS),然而该适应症市场潜力往往被投资者极大的低估。
MDS是一组异质性的造血干细胞疾病,又被称为“白血病前期”,其特征是骨髓、红细胞和巨核细胞祖细胞的发育异常,导致骨髓不能正常生成血细胞,出现外周血全血细胞减少、骨髓细胞增生以及病态造血,约1/3的MDS患者可进展为急性髓系白血病(AML)。当前,MDS治疗方案仍比较有限,患者多因细胞减少症相关的并发症或AML而死亡。
目前,全球每年MDS新增病例约10万例,中国MDS每年新发患者数量约2万人,以目前常用的药物阿扎胞苷为例,国内药物市场至少在10亿以上量级;美国MDS每年新发病例约4万人,死亡7000例/年。
目前低危MDS患者采用对症支持治疗手段为主,主要治疗目标为改善细胞减少症并减少输血,患者总体生存期差异很大(3-9年)且在5年内转化为AML概率为5-50%。
据高盛研报提供的数据显示,红细胞成熟剂罗特西普(Luspatercept )在2023年实现了10亿美元的全球销售(其中 美国的销售额为8.11亿美元),推测约5亿美元可能与低危MDS适应症市场相关;另外,美国Biotech公司Geron则是预计自家端粒酶抑制剂Imetelstat在低危MDS的总可寻址市场(TAM)为35亿美元。
相比低危MDS,中高危MDS占MDS总人群45%,患者中位年龄值较大,患者的中位生存期约18个月,急切需要更有效的创新治疗药物。
目前中高危MDS主要采用去甲基化药物(阿扎胞苷和地西他滨)或造血干细胞移植进行治疗,其中老年不耐受移植的患者主要采用去甲基化治疗,但存在ORR率较低、缓解维持时间短;另外,接受去甲基化治疗失败后的患者预后非常差,中位总生存期小于6个月,不到1/3的患者能存活1年,拥有大量未满足需求,据第三方机构推算,高危MDS预期市场规模至少在10-20亿美元。
血液瘤领域,AK117目前另一个主要适应症是急性髓细胞白血病(AML),AML成人中最常见的急性白血病类型,约占成人白血病的70%。尽管AML相关药物研发竞争激烈,数据显示2021年其市场规模接近10亿美元,预计2027年将达到约20亿美元。
03
联用背后的坦途
尽管过往CD47研发前辈们适应症探索集中在血液瘤,但谁说CD47不能干实体瘤?
2024年,康方生物不仅在8月开展了AK117联合阿扎胞苷治疗初诊较高危MDS的全球二期临床,随后在9月便开展AK112联合AK117对比K药一线治疗PD-L1表达阳性复发/转移性头颈部鳞状细胞癌三期临床,这也是全球*启动的CD47实体瘤疗法三期临床。
据康方生物介绍,CD47的上调,除了可抑制巨噬细胞的吞噬作用以外,也可抑制VEGF/VEGFR抑制剂的抗肿瘤作用;因此,同时阻断VEGF和CD47,可有效抑制抗血管生成治疗而诱导的免疫抑制途径,同时加强巨噬细胞吞噬作用,提高抗肿瘤疗效。
从康方生物的研发管线布局看,AK112与AK117的联用贯穿多个瘤种,包括胃癌、胆道癌、胰腺癌、乳腺癌和结直肠等。另外,AK117与AK104联用主要集中在胃癌领域。
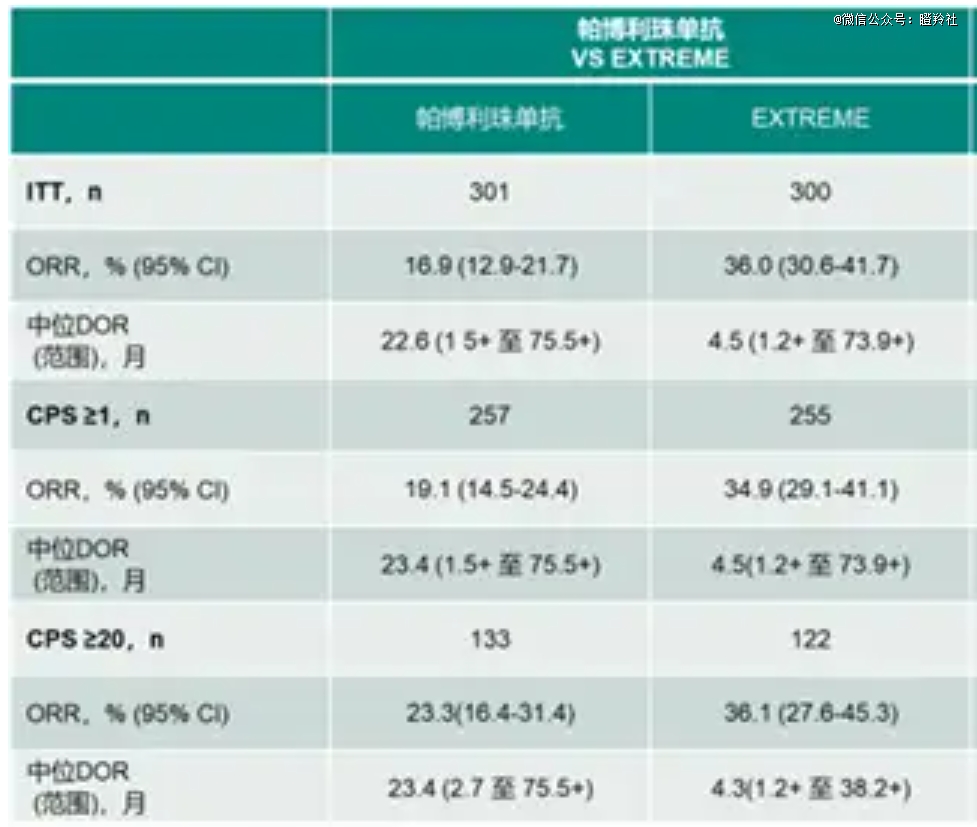
以复发/转移性头颈部鳞状细胞癌为例,过往EXTREME方案、K药联合化疗的中位OS普遍在1年左右,患者预后较差。
康方生物在2024 ESMO大会公布的AK112联用AK117组合二期研究数据显示(入组30人、56.7%的患者为CPS≥20):10例患者的AK112单药组ORR为30%、DCR为80%、中位PFS为5个月,20例患者的AK112联用AK117组ORR、DCR和PFS分别为60%、90%和7.1个月(20例患者中包括11例CPS≥20和9例1≤CPS<20患者)。
与AK112单药组对比,AK112与AK117的组合使得ORR翻倍的同时PFS也有很大的提升。若以该项二期临床与K药的KEYNOTE-48横向比较,可以得出AK112的AK117组合在ORR层面可能具备超越的潜力;另外,K药联合化疗组在KEYNOTE-48研究中面向PD-L1 CPS≥20及CPS≥1的患者取得了4.9个月的中位PFS,而AK112与AK117的组合在没有引入化疗的情况下在早期数据做出了7.1个月的mPFS,或许可以期待一下未来AK112与AK117更多的组合。
安全性方面,30名患者中有20名患者(66.6%)发生了治疗TRAE,仅有1名患者经历了3-4级 TRAE,未发生TRAE导致治疗停止或死亡。
(图源:医药杂谈社)
K药单药作为目前PD-L1阳性(CPS≥ 1)复发或转移性头颈部鳞状细胞癌的一线疗法,基于AK112与AK117组合表现出的潜力和K药历史数据对比,很有可能做出“围殴式”的优效。
在未来,AK112+AK117或加上化疗的策略,能否对K药单药或加化疗的一线疗法进行全面迭代?我们拭目以待。
结语:从康方生物整体的布局来看,AK112的海外临床的成功与否是一个决定性的奇点,那么AK117的成药与否,不仅是公司的一次豪赌,同时也是公司管线全面开花迭代冲击K药宝座的一个关键僚机。若皆成,大概率将会把康方生物带到一个*的高度。


 177710/15
177710/15